Thérapeutiques originales & technologies innovantes
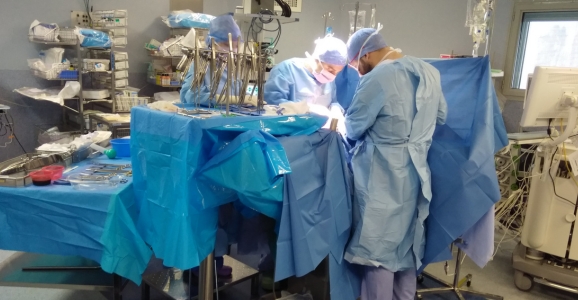
Chimiothérapie Hyperthermique Intrapéritonéale : CHIP
Chimiothérapie Hyperthermique IntraPéritonéale : une combinaison de la cytoréduction radicale, de la chimiothérapie intra-péritonéale et de l’hyperthermie.
La Chimiothérapie Hyperthermique IntraPéritonéale (CHIP) s’est développée dans les années 1990. L’indication originelle étaient les pseudomyxomes péritonéaux. Secondairement les indications ont été étendues à la carcinose d’origine colorectale et appendiculaire ainsi que le mésothéliome péritonéal puis plus récemment dans la carcinose d’origine ovarienne.
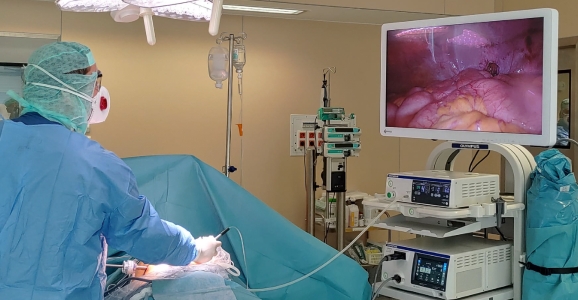
Chimiothérapie IntraPéritonéale Pressurisée Par Aérosols : PIPAC
Dans les situations où la carcinose est d’emblée très évoluée, ou si la cytoréduction complète n’est pas réalisable, la PIPAC (Pressurised Intra Peritoneal Aerosol Chemotherapy) est une nouvelle alternative thérapeutique qui se développe depuis les années 2010. Il s’agit de délivrer la chimiothérapie en intrapéritonéal, sous forme aérosolisée et pressurisée pour favoriser la pénétration tissulaire des drogues. Les séances de PIPAC sont pratiquées toutes les 6 à 8 semaines, associées à 2 cures de chimiothérapie intraveineuse pendant ce délai.
Le saviez-vous ?
Tous les dispositifs médicaux doivent obligatoirement être certifiés selon une réglementation stricte. En Europe, la conformité à cette réglementation est matérialisée par la délivrance du marquage CE médical qui garantit que le dispositif médical répond aux exigences de sécurité et de bénéfice clinique fixées.
Depuis mai 2021, les dispositifs médicaux sont soumis au nouveau règlement 2017/745 de l’Union Européenne (MDR : Medical Device Regulation).
Au 26 mai 2024, tous les dispositifs médicaux devront être marqués CE MDR ou avoir obtenu une extension de leur certificat suite à la mise en œuvre d’une démarche MDR via le dépôt d’une demande d’évaluation à un organisme notifié.
En France, la qualité et la sécurité (matériovigilance, contrôle, inspection) de tous les DM mis sur le marché sont également surveillées par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).


